1.3.- Primera Ley de la Termodinámica
Primera Ley de la Termodinámica o Ley de la Conservación de la Energía
La ley de la conservación de la energía constituye el primer principio de la termodinámica y establece que la energía no se crea, ni se destruye solo se transforma. Como consecuencia de ello, un aumento del contenido de energía de un sistema, requiere de una correspondiente disminución en el contenido de energía de algún otro sistema.
 Hay que tener en cuenta, que debido a que la energía puede cambiar de una forma a otra, una forma de energía perdida por un sistema puede haberla ganado otro en una forma diferente.
Hay que tener en cuenta, que debido a que la energía puede cambiar de una forma a otra, una forma de energía perdida por un sistema puede haberla ganado otro en una forma diferente.
Ejemplo: En el momento que el conductor de un automóvil lo pone en marcha, implica que la energía química liberada en la combustión de la gasolina del motor se transforma en trabajo, como consecuencia de él se produce un aumento en la energía cinética del automóvil y otra parte se transfiere como calor a los diferentes componentes del motor y al aire circundante.
Determinar el valor de la energía de los alrededores siempre será una tarea complicada.
En química, generalmente se estudian los cambios asociados al sistema, que puede ser un reactor, que contenga reactivos y productos, es decir el sistema será la reacción química que se esta realizando.
Primera Ley de la Termodinámica
Dentro de la termodinámica, una consecuencia de la ley de la conservación de la energía es la llamada Primera Ley de la Termodinámica, la cual establece que la variación de la Energía interna de un sistema es igual a la suma de la energía transferida en forma de calor y la energía transferida en forma de trabajo
![]() q = energía transferida en forma de calor
q = energía transferida en forma de calor
w= energía transferida en forma de trabajo.
Podemos concluir que la variación de energía interna de un sistema, es igual a la suma del intercambio de calor entre el sistema y los alrededores y el trabajo realizado por (o sobre) el sistema.
Para seguir adelante con la primera Ley de la Termodinámica debemos familiarizarnos con la Convención de Signos.
Si pensamos en la siguiente analogía, podremos comprender de manera practica, lo que implica la convención de signos. Pensemos en que nos han entregado una cantidad de soles, que guardamos en nuestro bolsillo; podemos describir este hecho como (+ soles); conforme vayamos gastando el dinero, los soles que salen del bolsillo los podemos representar como (– soles).
Si esta analogía la trasladamos a la priemra ley de la termodinámica podemos entender el diagrama que se da a continuación.
 El calor que ingresa a un sistema y el trabajo realizado sobre el sistema, tendrán signo ( + ); mientras que el calor liberado por el sistema, o el trabajo realizado por el sistema sobre el entorno, tendrá signo ( – ).
El calor que ingresa a un sistema y el trabajo realizado sobre el sistema, tendrán signo ( + ); mientras que el calor liberado por el sistema, o el trabajo realizado por el sistema sobre el entorno, tendrá signo ( – ).
La convención de signos, son criterios pautados, estos pueden variar según los paises, la que emplearemos nosotros será la señalada.
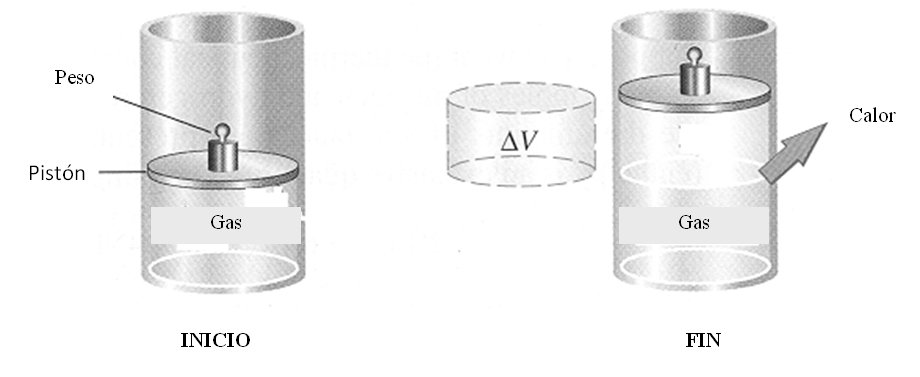
Observemos el diagrama siguiente:
- El cilindro marcado con INICIO, tiene un pistón móvil ( puede subir o puede bajar).
- En el interior del cilindro se encuentra un GAS.
- El sistema es cerrado, no ingresa ni sale materia. La cantidad de gas en el interior del cilindro no varía.
- El cilindro de la derecha, marcado con FIN, nos muestra la misma cantidad de gas, sólo que éste ha sufrido una expansión a presión constante, es decir, ha aumentado su volumen.
Podemos observar, en el diagrama, que el sistema GAS, ha ejercido un trabajo sobre el entorno, w < 0
Si el trabajo lo podemos representar como w = F.d
Y recordamos que la presión es
![]() Reagrupando términos y observando el diagrama anterior podemos establecer que:
Reagrupando términos y observando el diagrama anterior podemos establecer que:
El signo negativo se asigna debido a que, el SISTEMA ha ejercido trabajo (w) SOBRE el entorno.