1.2.- Propiedades Termodinámicas
Las propiedades termodinámicas son el calor (q), el trabajo (w) y la energía interna (E).
CALOR (q)
Unidades: J, kJ, cal |
El calor en termodinámica se considera como la energía que fluye al entrar en contacto 2 sustancias que se encuentran a diferente temperatura. El calor siempre fluye del cuerpo caliente al cuerpo frío.
Por convención el calor que sale de un sistema tiene signo negativo; mientras que el calor que ingresa a un sistema tiene signo positivo.
Temperatura?propiedad intensiva.
Calor?propiedad extensiva
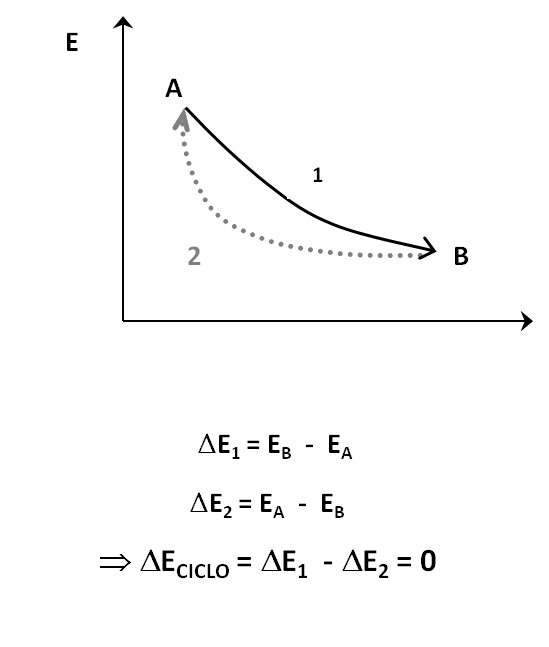
El calor no es Función de Estado, depende del camino recorrido.
|
TRABAJO (w)
Unidades: J, kJ, cal |
El trabajo en termodinámica siempre representa un intercambio de energía entre un sistema y su entorno.w = F x d
w= (kg.m.s-2).m
w= kg.m2s-2 = 1 Joule
Por convención el trabajo que realiza el entorno sobre el sistema tiene signo positivo; mientras que si el sistema el que realiza trabajo sobre el entorno tiene signo negativo.
El trabajo no es Función de estado, depende del camino recorrido. |
ENERGÍA INTERNA (E)
Unidades: J, kJ,cal |
La Energía interna, es la suma de todas las energías existentes en el sistema (cinética, térmica, potencial, etc). Algunos autores la representan con la letra U
No se puede determinar, en forma absoluta, por lo tanto lo que se mide es la variación de energía interna del sistema (Delta de E). Es propiedad extensiva, dependerá de la cantidad y calidad de materia. Es propiedad extensiva, dependerá de la cantidad y calidad de materia.
La Energía Interna es función de estado, no depende del camino recorrido.
|
Postulados Termodinámicos
- Las propiedades de un sistema en equilibrio termodinámico, son funciones de estado.
- El contenido de energía es una función puntual del estado del sistema. (una cantidad fija de materia no tiene la misma energía asociada a otra condición)
- En cualquier ciclo termodinámico por el cual el sistema es restaurado a su estado inicial, la suma algebraica de los intercambios de energía con los sistemas limitantes es cero.
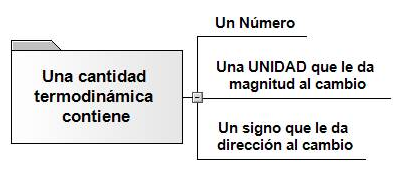
Cantidad Termodinámica
 |
- En una reacción química, el estado inicial esta determinado por los reactantes y el estado final por los productos de la reacción.
A + B ? C + D
Estado Inicial Estado Final
|
Unidades de la energía en el Sistema Internacional (SI)
La unidad derivada de energía en el SI es el Joule.
1 Joule (J) = 1 kg m2/s2 = 1 N m
por lo general emplearemos 1 kJ que equivale a 103 J.
Otras unidades de uso frecuente y sus equivalencias
1 Caloría = 4,184 J
1 electrón – voltio (eV) = 1,602 x 10-19 J
1 L atm = 101,325 J
1 unidad térmica británica (Btu) = 1055 J



