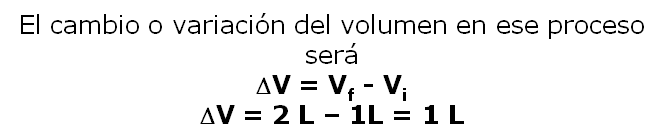1.1.- Definiciones Básicas
Antes de entrar en el estudio de los principios de la termodinámica, es necesario introducir algunas nociones preliminares, como qué es un sistema termodinámico, cómo se describe, qué tipo de transformaciones puede experimentar, etc.
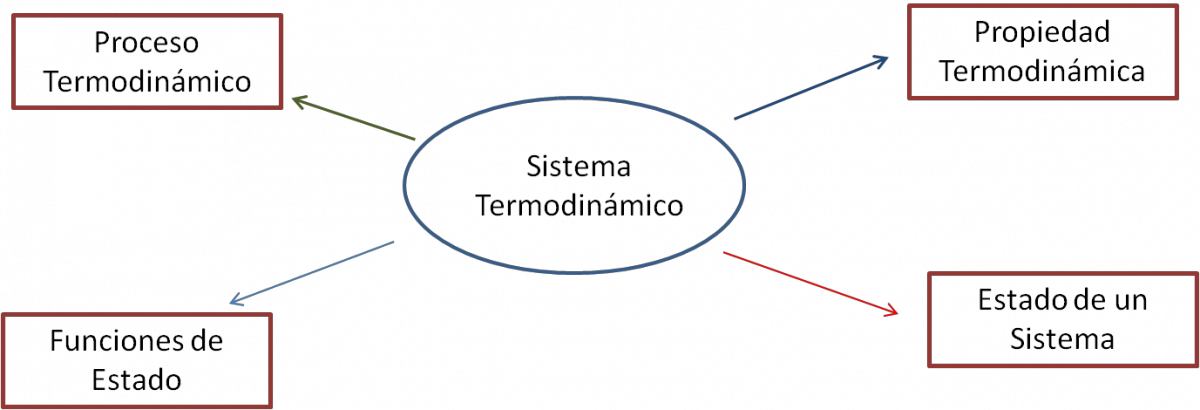
Estos conceptos están resumidos en el siguiente cuadro:
Sistemas Termodinámico
Durante el estudio de la termodinámica debemos delimitar de forma precisa la parte o porción del Universo que será objeto de nuestro estudio.
Se definirán como:
- Sistema: a la parte del Universo que es el objeto de estudio. Un sistema puede ser una parte de un motor, un calentador de agua, el café contenido en una taza, una reacción química.
- Entorno o alrededores: a todo aquello que no forma parte del sistema, el entorno es la porción del Universo que no se va a estudiar, pero que puede interaccionar con el sistema.
Dicho de otra manera el entorno es todo aquello que no es parte del sistema.
- Límite o frontera: a la separación real o imaginaria entre el sistema y los alrededores. En el caso de que centremos nuestro estudio en el café el limite o frontera será la taza que lo contiene; en una reacción química será el recipiente donde se realice la reacción.
Es muy importante para la formulación de cualquier problema termodinámico la clara definición del sistema termodinámico y la frontera.
Así, los sistemas termodinámicos se pueden clasificar en:
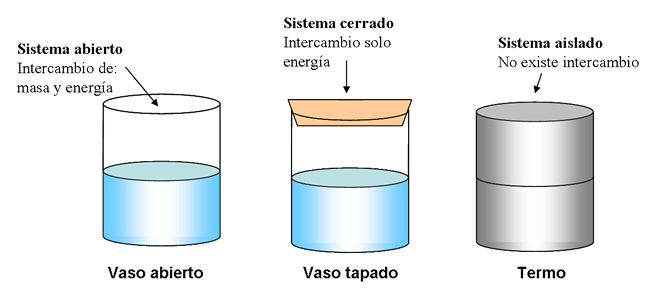
Abiertos: aquellos que pueden intercambiar materia y energía.
Cerrados: son aquellos que pueden intercambiar energía, aunque no materia, con los alrededores.
Aislados: que no pueden intercambiar ni materia ni energía.
 http://ocw.uc3m.es/ciencia-e-oin/quimica-de-los-materiales/Material%20de%20clase/tema5b.htm
http://ocw.uc3m.es/ciencia-e-oin/quimica-de-los-materiales/Material%20de%20clase/tema5b.htm
 |
UNIVERSO = SISTEMA + ENTORNO
|
Propiedad Termodinámica
Es cualquier característica observable y mensurable de un sistema que permiten definirlo en forma total y sin ambigüedad.
Las propiedades termodinámicas son Presión, Volumen y Temperatura.
Las propiedades pueden ser extensivas e intensivas
Una propiedad intensiva es aquella que es independiente de la materia. Es decir, tiene el mismo valor para un sistema que para cada una de sus partes consideradas como subsistemas del mismo.
Ejemplo: si tenemos un cilindro que contiene aceite, la densidad del mismo será una variable intensiva, dará lo mismo medir la densidad del aceite en todo el cilindro o sacar una porción de él y medir la densidad.
Una propiedad extensiva es aquella que si depende de la materia. Es decir una magnitud cuyo valor es proporcional al tamaño del sistema que describe. Esta magnitud puede ser expresada como suma de las magnitudes de un conjunto de subsistemas que formen el sistema original.
Ejemplo la masa y el volumen son variables extensivas.
 |
Ejercicio 1.2 Si se tiene una plancha de hierro de 20 x 20 cm y un clavo de hierro de 2 cm, ambos están al “rojo vivo”. ¿Tendrán la misma temperatura, generarán el mismo calor? Analiza la situación y determina si el calor y la temperatura son propiedades intensivas o extensivas. |
| Calor | Propiedad extensiva |
| Temperatura | Propiedad intensiva |
Estado de un Sistema
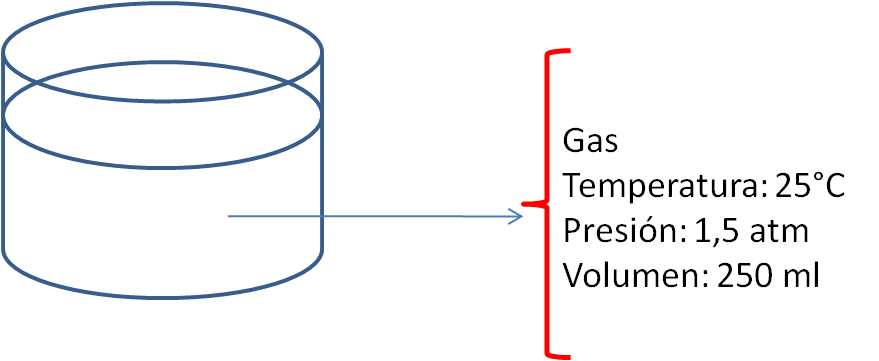
Se define como los valores de todas las propiedades macroscópicas que caracterizan al sistema, como por ejemplo: composición, energía, presión, temperatura y volumen.
Expresado de otra manera se puede decir que el Estado de un Sistema queda definido, cuando se da el númeromínimo de propiedades termodinámicas que fijan el sistema.
En la siguiente figura se ha representado un gas encerrado en un recipiente y las propiedades termodinámicas que describen su estado.
Proceso Termodinámico
El proceso termodinámico se da cuando cambia el estado de un sistema, en este cambio pueden variar una o más propiedades del sistema. Para describir un proceso se deben especificar cada uno de los estados intermedios, lo que ocurre al inicio y lo que ocurre al final del proceso.
En todo proceso termodinámico se debe especificar el estado incial y el estado final.
Ejemplo: en un recipiente se tiene 25 mL de agua, a 20°C y 1 atm de presión (estado incial). Si el recipiente se introduce en un congelador que se encuentra a -4°C (estado final). Se ha procucido un proceso termodinámico, la variable temperatura se ha modificado.
Clases de Procesos termodinámicos
| Isotérmico | Temperatura constante.
PV = K |
| Isobárico | Presión constante
V/ T = k |
| Isocórico | Volumen constante
P/T = k |
| Adiabático | No hay transferencia de calor (q)
q= 0 |
| Reversible | Se regresa mediante una condición de equilibrio al estado inicial.
Ejemplo: H2O(l,100ºC,1atm)? H2O(vapor,100ºC,1atm) |
| Irreversible | El cambio ocurre y no se puede regresar al estado inicial.
Ejemplo: una explosión. |
| Cíclico |
Después de realizar una serie de cambios, el sistema regresa a su condición inicial. |
Función de Estado
Son propiedades determinadas por el estado en que se encuentre el sistema, independiente de cómo se haya alcanzado.
En otras palabras, cuando cambia el estado de un sistema, la magnitud del cambio de cualquier función de estado dependerá de la situación inicial y la final, y no de cómo se efectuó dicho cambio.
 |
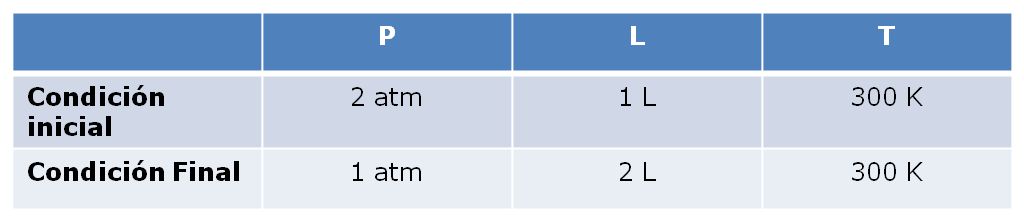
Por ejemplo: el estado de cierta cantidad de gas se específica por con su Volumen, Presión y Temperatura. Si consideramos un gas XX que se encuentra a 2 atm, 300 K y 1,0 L (Estado inicial). Supón ahora que se realiza un proceso termodinámico a temperatura constante (Proceso isotérmico), en el que la presión del gas disminuye a 1 atm. De acuerdo a la Ley de Boyle, el volumen deberá aumentar a 2 L. No importa cómo se alcanzó el estado final. La presión del gas, pudo haber aumentado al principio y después disminuido a 1 atm). Podemos concluir por lo tanto el volumen es una función de estado. De igual manera se puede determinar que la presión y la temperatura también son función de estado. El valor de una función de estado no depende de la historia específica de la muestra; sólo depende de la situación inicial y final”.
|
 |
Ejercicio 1.3 Se desea preparar un café tibio para una persona . La temperatura aproximada que se desea para el café es de 35 °C. Para ello podemos seguir cualquiera de los procedimientos siguientes: |
| Procedimiento 1 | Calentar el volumen deseado de agua en un horno microondas. |
| Procedimiento 2 | Mezclar un poco de agua fría con otro poco de agua caliente para obtener el volumen y la temperatura deseados. |
| Procedimiento 3 | Calentar en una olla el volumen deseado de agua, hasta alcanzar la temperatura. |
Teniendo en cuenta lo anterior, responde:
|
|
|
|