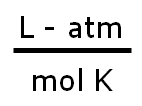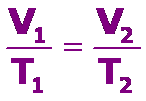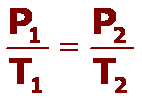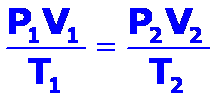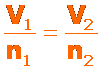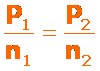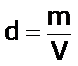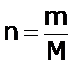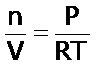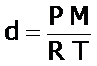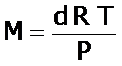Gas ideal: es el comportamiento que presentan aquellos gases cuyas moléculas no interactúan entre si y se mueven aleatoriamente. En condiciones normales y en condiciones estándar, la mayoría de los gases presentan comportamiento de gases ideales.
Ley de Boyle
Si se reduce la presión sobre un globo, éste se expande, es decir aumenta su volumen, siendo ésta la razón por la que los globos meteorológicos se expanden a medida que se elevan en la atmósfera. Por otro lado, cuando un volumen de un gas se comprime, la presión del gas aumenta. El químico Robert Boyle (1627 – 1697) fue el primero en investigar la relación entre la presión de un gas y su volumen.
La ley de Boyle, que resume estas observaciones, establece que: el volumen de una determinada cantidad de gas, que se mantiene a temperatura constante, es inversamente proporcional a la presión que ejerce, lo que se resume en la siguiente expresión:
P.V = constante o P = 1 / V
y se pueden representar gráficamente como:
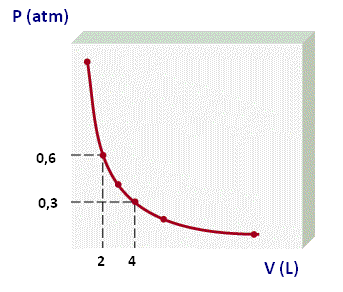
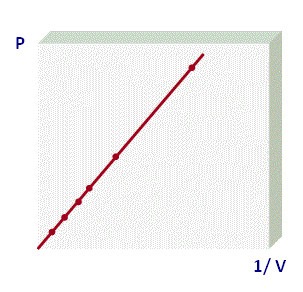
La forma que más utilizamos para representar la Ley de Boyle corresponde a la primera gráfica, donde se muestra a un rama de una hipérbola equilátera y podemos usar la siguiente expresión para determinar los valores de dos puntos de la gráfica:
P1 . V1 = P2 . V2
Este tipo de gráficos se denominan
isotermas, por lo que a los procesos que cumplen con la Ley de Boyle se les denomina
procesos isotérmicos. Para visualizar un video que muestra un experimento de la ley de Boyle, haz click
aquí.
 |
Recuerda
Para que para que se cumpla la Ley de Boyle es importante que permanezcan constantes el número de moles del gas, n, y la temperatura de trabajo, T. |
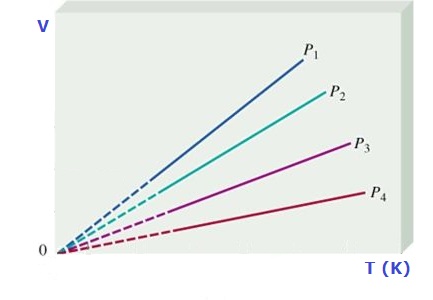
Ley de Charles
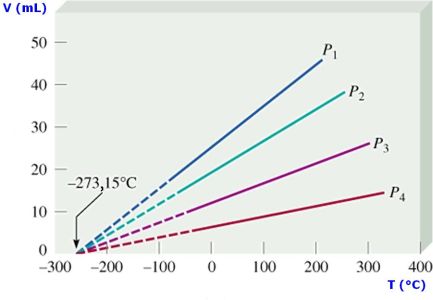
Cuando se calienta el aire contenido en los globos aerostáticos éstos se elevan, porque el gas se expande. El aire caliente que está dentro del globo es menos denso que el aire frío del entorno, a la misma presión, la diferencia de densidad hace que el globo ascienda. Similarmente, si un globo se enfría, éste se encoge, reduce su volumen. La relación entre la temperatura y el volumen fue enunciada por el científico francés J. Charles (1746 – 1823), utilizando muchos de los experimentos realizados por J. Gay Lussac (1778 – 1823).
La ley de Charles y Gay Lussac se resume en: el volumen de una determinada cantidad de gas que se mantiene apresión constante, es directamente proporcional a su temperatura absoluta, que se expresa como:
y gráficamente se representa como:
Debemos tener presente que la temperatura se DEBE expresar en grados Kelvin, K. Para determinar los valores entre dos puntos cualesquiera de la recta podemos usar:
Los procesos que se realizan a presión constante se denominan procesos isobáricos.
Análogamente, la presión de una determinada cantidad de gas que se mantiene a volumen constante, es directamente proporcional a su temperatura absoluta, que se expresa como:
Los procesos que se producen a volumen constante se denominan procesos isocóricos. Para determinar los valores entre dos estados podemos usar:
En los siguientes videos puedes apreciar los efectos de la Ley de Charles:
AQUÍ VA EL VIDEO DE videos pucp
Ley de los cambios triples
Al combinar las leyes mencionadas se obtiene la ley combinada de los gases ideales o ley de los cambios triples, que establece que para una determinada cantidad de gas se cumple:
Para determinar los valores entre dos estados diferentes podemos emplear:
 |
Recuerda:
- En las leyes estudiadas se debe mantener constante el número de moles del gas en estudio.
- Es necesario trabajar en temperatura absoluta, es decir en grados Kelvin, K.
|
Ley de Avogadro
A medida que agregamos gas a un globo, éste se expande, por lo tanto el volumen de un gas depende no sólo de la presión y la temperatura, sino también de la cantidad de gas.
La relación entre la cantidad de un gas y su volumen fue enunciada por Amadeus Avogadro (1778 – 1850), después de los experimentos realizados años antes por Gay – Lussac.
La ley de Avogadro establece que el volumen de un gas mantenido a temperatura y presión constantes, es directamente proporcional al número de moles del gas presentes:
Para determinar los valores para dos estados diferentes podemos usar:
También podemos expresarlo en términos de: la presión de un gas mantenido a temperatura y volumen constantes, es directamente proporcional al número de moles del gas presentes:
 |
Observación
Los experimentos demostraron que a condiciones TPE, 1 mol de una sustancia gaseosa cualquiera, ocupa un volumen de 22,4 L. |
Ley general del gas ideal
Las leyes que hemos estudiado se cumplen cuando se trabaja a bajas presiones y temperaturas moderadas. Tenemos que:
| Propiedades que se mantienen constantes |
Ley |
Expresión |
| moles, n |
temperatura, T |
Boyle |
P.V = constante |
| moles, n |
presión, P |
Charles |
V / T = constante |
| presión, P |
temperatura, T |
Avogadro |
V / n = constante |
Cuando estas leyes se combinan en una sola ecuación, se obtiene la denominada ecuación general de los gases ideales:
P V = n R T
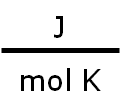
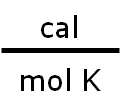
donde la nueva constante de proporcionalidad se denomina R, constante universal de los gases ideales, que tiene el mismo valor para todas las sustancias gaseosas. El valor numérico de R dependerá de las unidades en las que se trabajen las otras propiedades, P, V, T y n. En consecuencia, debemos tener cuidado al elegir el valor de R que corresponda a los cálculos que estemos realizando, así tenemos:
Como hemos observado, son cuatro (4) las propiedades que definen el estado o las condiciones en las que se encuentrauna sustancia en estado gaseoso: la cantidad de sustancia o número de moles, n; la presión que ejercen sus moléculas, P; la temperatura a la que se encuentra, T y el volumen que ocupa, V. Estas propiedades pueden variar todas simultáneamente o se pueden mantener constantes una o dos de ellas a fin de cambiar las otras, como se puede apreciar en el siguiente video:
Densidad y masa molar de un gas ideal
La ecuación de los gases ideales permite determinar la densidad, d, y la masa molar, M, de un determinado gas ideal.
Según las definiciones de densidad, d, el número de moles, n, y de la ecuación del gas ideal tenemos:
De donde obtenemos:
| densidad, d |
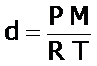 |
| masa molar, M |
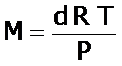 |