5.2. El estado gaseoso
Los gases intervienen en muchos aspectos de nuestra vida cotidiana, ya sea de manera positiva ayudándonos en nuestras labores, o de manera negativa perjudicando nuestro medio ambiente, así por ejemplo:
- el aire que respiramos, que nos proporciona el oxígeno que requerimos para respirar y mantenernos vivos,
- el GNV o gas natural vehicular, proveniente del gas de Camisea, que permite que los veículos se movilicen con una menor inversión en combustible,
- el gas propano que usamos en casa para preparar los alimentos o calentar el agua de la terma,
- el aire presente en las llantas de algunos vehículos,
- la mezcla gaseosa que se usan en las soldaduras, formada por acetileno combinado con oxígeno,
- el aire enriquecido que se emplea en submarinismo, son mezclas que además de oxígeno contienen helio, nitrógeno,
- los gases que se emanan junto con la lava en las erupciones volcánicas,
- los gases que se desprenden de los tubos de escape de los vehículos o de las chimeneas de las fábricas, y que contaminan nuestro ambiente.
 |
 |
 |
 |
| http://www.sxc.hu | dalasa.obolog.com
Google imágenes |
universalocean.es
Google imágenes |
Google imágenes |
 |
 |
 |
|
biodisol.com Google imágenes |
planetark.org
Google imágenes |
volcanoes.usgs.gov Google imágenes |
Las características que define a los gases son:
- pueden ser confinados en un recipiente, ocupando todo el volumen del que disponen y adquiriendo la forma del recipiente que los contiene,
- son altamente compresibles,
- se combinan fácilmente cuando varios gases se confinan en un mismo recipiente,
- sus densidades son mucho menores que las de los sólidos y los liquidos;
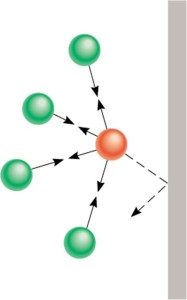
esto es debido a que la distancia entre las moléculas es mucho más grande que en el estado líquido o en el estado sólido y, porque las moléculas se encuentran en constante movimiento.
Son cuatro los parámetros que definen el comportamiento de las sustancias en el estado gaseoso: la presión, P, elvolumen, V, la temperatura, T y la cantidad de sustancia en estudio, n. Todos estos parámetros están relacionados entre sí en base a las teorías de los gases ideales.
Se consideran gases a aquellas sustancias que a condiciones normales, existen naturalmente en el estado gaseoso, mientra que cuando una sustancia, líquido o sólido, se evapora, se dice que se encuentra en fase gas. En la siguiente tabla se muestran algunos gases y sus propiedades.
|
Nombre |
Fórmula |
Color |
Olor |
Toxicidad |
|---|---|---|---|---|
| Amoníaco | NH3 | Incoloro | Penetrante | Tóxico |
| Dióxido de carbono | CO2 | Incoloro | Inodoro | No tóxico |
| Monóxido de carbono | CO | Incoloro | Inodoro | Muy tóxico |
| Cloro | Cl2 | Verde pálido | Irritante | Muy tóxico |
| Helio | He | Incoloro | Inodoro | No tóxico |
| Neón | Ne | Incoloro | Inodoro | No tóxico |
| Hidrógeno | H2 | Incoloro | Inodoro | No tóxico |
| Cloruro de hidrógeno | HCl | Inodoro | Irritante | Tóxico |
| Sulfuro de hidrógeno | H2S | Incoloro | Fétido | Muy tóxico |
| Metano | CH4 | Incoloro | Inodoro | No tóxico |
| Nitrógeno | N2 | Incoloro | Inodoro | No tóxico |
| Dióxido de nitrógeno | NO2 | Marrón rojizo | Irritante | Muy tóxico |
| Oxígeno | O2 | Incoloro | Inodoro | No tóxico |
 |
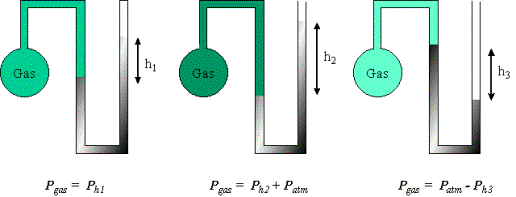
Observación La atmósfera terrestre consiste de una mezcla de gases que rodea la Tierra, se mantiene sobre ella gracias a la acción de la gravedad y como es materia, ejerce presión sobre la superficie terrestre. Este hecho fue demostrado por Evangelista Torricelli (1606 – 1647); para ver una breve explicación del experimento puedes pulsar aquí. En el siguiente video puedes evidenciar el efecto de la presión atmosférica: |
Para medir la presión de un gas que se encuentra dentro de un recipiente se usan generalmente manómetros de mercurio, Hg, como se muestran en la figura y que operan de la siguiente manera: