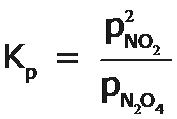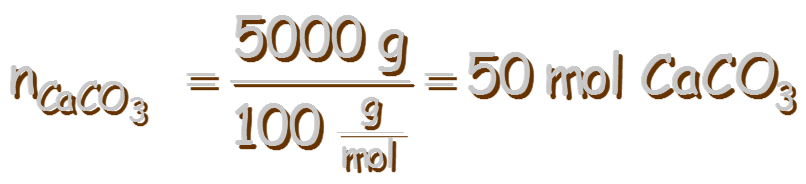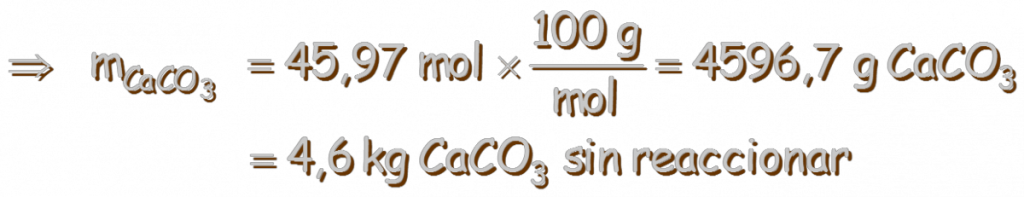3.4. Equilibrio Molecular
El equilibrio molecular es aquel en el que todas las sustancias participantes son moleculares. Éste puede ser de dos tipos, homogéneo y heterogéneo.
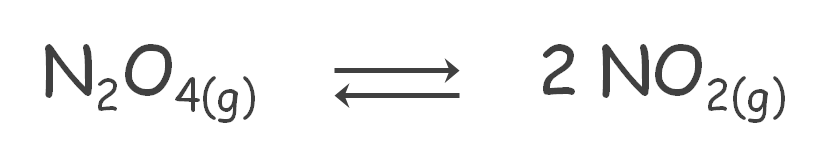
Equilibrio Homogéneo
El término se aplica a las reacciones en las que todas las especies participantes (reactivos y productos) se encuentran en la misma fase, como:
Equilibrio Heterogéneo
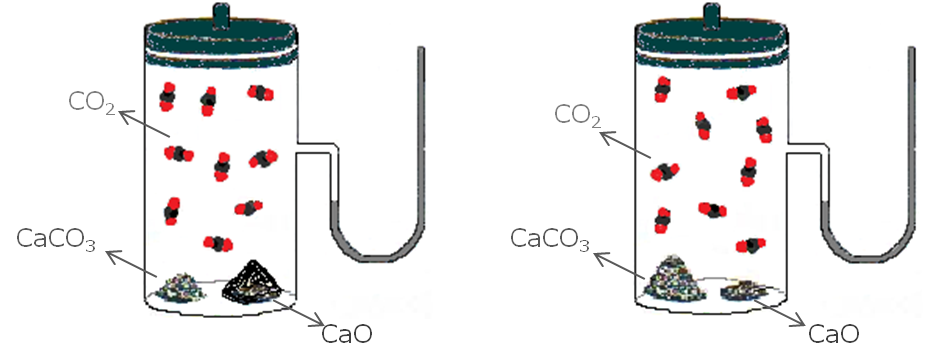
Una reacción reversible en la que intervienen reactivos y productos en distintas fases conduce a un equilibrio heterogéneo, por ejemplo:
Donde los dos sólidos y el gas constituyen fases distintas a una misma temperatura.
Debemos recordar:
| Estado de la materia | Actividad, a |
|---|---|
| gases | presión parcial, p |
| sólidos puros | 1 |
| líquidos puros | 1 |
| disoluciones | molaridad, M, (mol/L) |
Como sabemos, K se define en términos de actividades, a, que son magnitudes adimensionales, en consecuencia, para la reacción dada, su constante de equilibrio será:
 El valor de K no depende de las cantidades de CaCO3(s) y CaO(s) presentes, siempre y cuando algo de cada uno de ellos se encuentren presentes en el equilibrio:
El valor de K no depende de las cantidades de CaCO3(s) y CaO(s) presentes, siempre y cuando algo de cada uno de ellos se encuentren presentes en el equilibrio:
 |
Importante A pesar que los sólidos y líquidos puros no aparecen en la expresión de la constante de equilibrio, K, éstos deben estar presentes para que se establezca el equilibrio. |