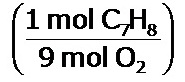4.2. Relaciones estequiométricas y cálculos con estequiometría
La estequiometría establece relaciones entre las moléculas o elementos que conforman los reactivos de una ecuación química con los productos de dicha reacción. Las relaciones que se establecen son relaciones MOLARES entre los compuestos o elementos que conforman la ecuación quimica: siempre en MOLES, NUNCA en gramos.
Analicemos la siguiente ecuación química balanceada: C7H8 + 9 O2 → 7 CO2 + 4 H2O
Podemos establecer las siguientes relaciones:
- Por 1 mol de C7H8 que reacciona, se necesitan 9 moles de O2. En pocas palabras, estamos estableciendo una regla de tres, la cual también la podemos escribir como un factor de conversión unitario:
- También podemos establecer relaciones entre las moles de O2 y las moles de CO2 producidas o la relación entre las moles de H2O producidas y la cantidad de O2 necesarias para producirla, tal y como podemos observar en las siguientes relaciones estequiométricas:
CÁLCULOS CON ESTEQUIOMETRÍA
Una reacción química balanceada, nos informa sobre las relaciones molares entre reactantes y productos.
Cuando se lleva a cabo una reacción química ya sea, en el laboratorio, en una fábrica o en la naturaleza, las cantidades que se emplean pueden ser muy variadas y se conocen como las condiciones de reacción. Las relaciones estequiométricas, nos permitirán conocer la cantidad de producto que esperamos en las reacciones químicas, dicho de otra manera, estas relaciones nos permiten conocer cuánto se producirá o cuánto se necesitará de una sustancia, cuando la reacción ocurre a esas condiones.
Por ejemplo, si nos piden calcular:
¿Cuántos moles de cloruro de magnesio (MgCl2), se producirán, si se hacen reaccionar 2,4 g de Mg con suficiente cantidad de ácido clorhídrico (HCl)? (estas son las condiciones de reacción).
La reacción química es la siguiente:
Mg(s) + HCl(ac) → MgCl2(ac) + H2(g)
El primer paso será balancear la ecuación, esto permite conocer las relaciones estequiométricas existentes entre reactivos y productos.
Mg(s) + 2 HCl(ac) → MgCl2(ac) + H2(g)
El segundo paso, como las relaciones estequiométricas se establecen en moles, debemos conocer a cuántas moles equivale la cantidad en gramos del reactivo. Si la masa molar del Mg es igual a 24 g/mol, tendremos que a las condiciones de la reacción descrita anteriormente, se están haciendo reaccionar 0,1 mol de Mg.
El tercer paso, analizamos las relaciones estequiométricas descritas en la ecuación balanceada. Podemos ver que la relación entre el Mg (reactivo) y el MgCl2 (producto) es 1:1; por lo que podemos concluir que a las condiciones de esa reacción se producirán 0, 1 mol de MgCl2.
Calculen ustedes la cantidad:
-
De gas H2 que se producirán en está reacción, expresen está cantidad tanto en moles como en gramos.
-
De ácido clorhídrico (HCl), que serán necesarios para que todo el Mg reaccione.