3.4.5. Polaridad de moléculas
¿Por qué el agua se mezcla homogéneamente con el alcohol y no es capaz de mezclarse con el aceite? La solubilidad es una propiedad física que se relaciona directamente con la polaridad de las moléculas. En esta parte, aprenderemos a establecer si una molécula es polar o no polar (apolar). La polaridad es una propiedad de las moléculas que representa la separación de las cargas eléctricas dentro de la molécula, según el número y tipo de enlaces que posea.
El enlace covalente entre dos átomos puede ser polar o apolar. Esto depende del tipo de átomos que lo conforman: si los átomos son iguales, el enlace será apolar (ya que ningún átomo atrae con más fuerza los electrones). Pero, si los átomos son diferentes, el enlace estará polarizado hacia el átomo más electronegativo, ya que será el que atraiga el par de electrones con más fuerza. Consideremos el enlace H-H y H-F:
Vemos que en el enlace H-H ningún átomo es más electronegativo que el otro. Por tanto, el par de electrones no se polariza y podemos decir que el momento dipolar (µ) es cero. En el caso del enlace H-F, el flúor es más electronegativo que el hidrógeno. Por tanto, el par de electrones se siente atraído hacia el flúor. Podemos representar esta polarización del enlace por medio de una flecha, que SIEMPRE apunta al átomo más electronegativo. En el caso del H-F, el momento dipolar (µ) es diferente de cero.
El momento dipolar es una medida cuantitativa de la polaridad de una molécula. En presencia de un campo eléctrico, aquellas moléculas polares (es decir, aquellas con un momento dipolar diferente a cero) son alineadas en la dirección del campo, mientras que las moléculas apolares no se ven afectadas.
En el caso de moléculas con más de dos átomos, el momento dipolar dependerá de la polaridad de todos sus enlaces y de la geometría molecular. La presencia de enlaces polares NO IMPLICA necesariamente que la molécula sea polar.
 |
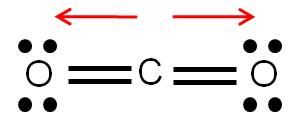
Ejemplo 3.11. Analicemos la molécula de CO2. |
Es una molécula lineal, como lo hemos determinado previamente, donde el oxígeno es más electronegativo que el carbono. Por tanto, existirá un vector dipolo orientado hacia cada uno de los oxígenos:
Sin embargo, ambos dipolos tienen igual magnitud pero sentido opuesto. Si sumamos tales vectores dipolo, se eliminarán, dando un momento dipolar total de cero. Por tanto, la molécula de CO2 es apolar.
 |
Ejemplo 3.12. Veamos qué pasa ahora en la molécula de agua (H2O). |
Es un caso similar al ejemplo 3.11, sólo que, en este caso, los vectores apuntan al átomo central, ya que es el más electronegativo:
Sin embargo, en este caso debemos recordar que la molécula de agua no es lineal, sino angular. Por tanto, tales vectores, al ser sumados, no se eliminarán, sino que darán un vector resultante tal como se muestra a continuación:
Por tanto, la molécula de agua es polar: tiene un momento dipolar resultante.
Las moléculas con geometría tetraédrica también pueden ser apolares, aunque resulta más difícil representar tales vectores en una molécula tridimensional.
 |
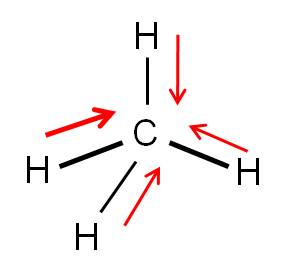
Ejemplo 3.13. Veamos la molécula de metano (CH4). |
El carbono es ligeramente más electronegativo que el hidrógeno. Por tanto, tenemos lo siguiente:
Al momento de sumar los vectores, éstos se anularán, debido a la simetría de la molécula. Por tanto, la molécula de metano es apolar. Algo diferente ocurre en la molécula de clorometano (CH3Cl), donde un átomo de hidrógeno ha sido reemplazado por cloro: la simetría se pierde, y por tanto, los vectores no se anulan. El CH3Cl es polar.
¿Y por qué es importante la polaridad? Pues porque en química se dice que “lo semejante se mezcla con lo semejante”. Aquellas sustancias polares tienden a mezclarse entre sí, mientras que las apolares prefieren mezclarse con sustancias apolares. El aceite es una sustancia apolar, y podemos verificar esto al mezclar aceite con agua (sustancia polar): se generan dos fases. No existe la misma polaridad y, por tanto, no se mezclan.