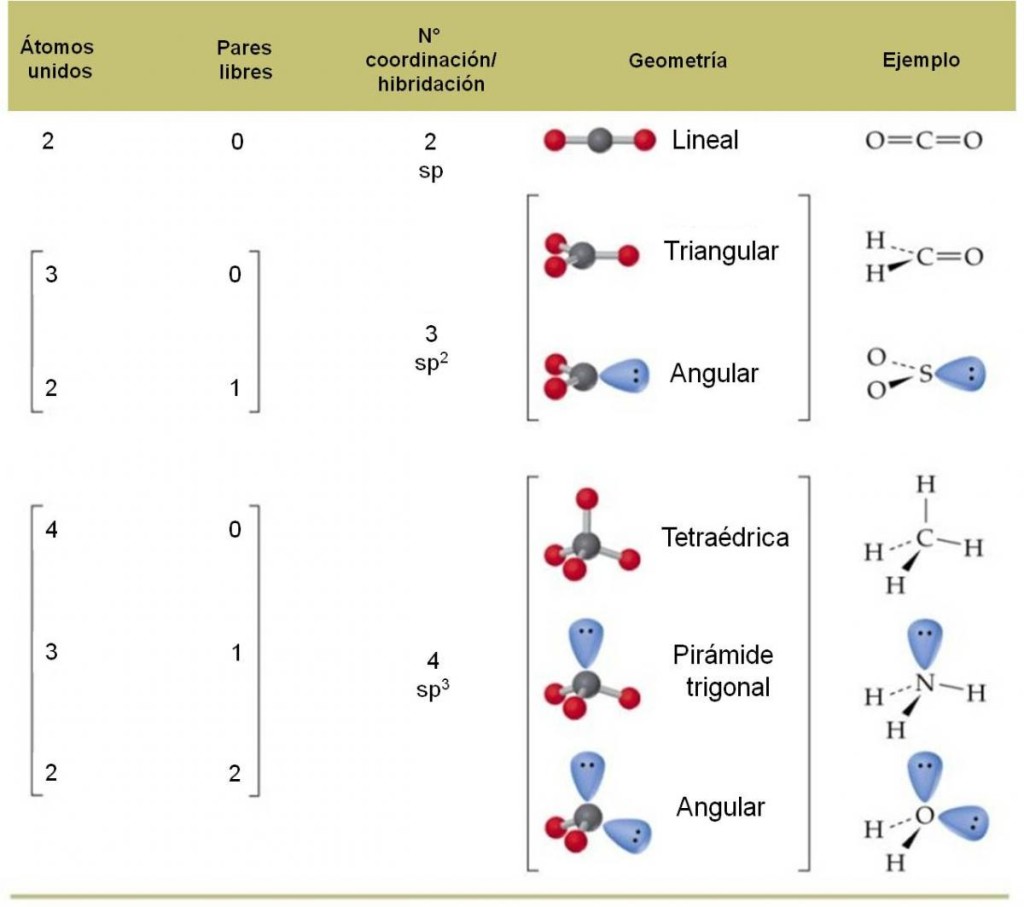
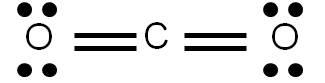3.4.4. Geometría molecular – Teoría RPECV
La geometría molecular es la disposición tridimensional de los átomos que conforman una molécula. Es muy importante conocer correctamente la geometría de una molécula, ya que está relacionada directamente con la mayoría de propiedades físicas y químicas, como por ejemplo, punto de ebullición, densidad, solubilidad, etc.
Si conocemos la estructura de Lewis de una molécula, podremos predecir su geometría utilizando la teoría de repulsión de pares electrónicos de la capa de valencia (RPECV). Esta teoría se basa en el hecho que los electrones tienden a repelerse entre sí (por similitud de cargas). Por tal motivo, los orbitales que contienen a los electrones se orientan de tal forma que queden lo más alejados entre sí.
Es importante notar que la geometría de la molécula está referida siempre al átomo central, y que, para determinarla correctamente, debemos conocer el número de coordinación total de dicho átomo.
N° coordinación = N° átomos unidos + N° pares libres
 |
Ejemplo 3.7. Analicemos la molécula de CO2. |
Previamente hemos determinado su estructura de Lewis, la cual es la siguiente:
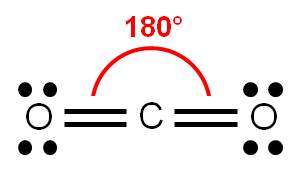
Determinemos el número de coordinación del carbono (átomo central): tiene dos átomos unidos y ningún par libre. Por tanto, su número de coordinación es 2, debido a los dos átomos de oxígeno unidos. Estos átomos querrán estar lo más alejado posible entre sí, y para ello, deberán oponerse entre sí 180°.
Por tanto, dado que los tres átomos pueden ser colocados a lo largo de una línea recta, decimos que la geometría de la molécula de CO2 es LINEAL. Observa la hibridación del carbono: es sp.
 |
Observación Cualquier molécula diatómica (formada sólo por dos átomos) será necesariamente lineal. |
 |
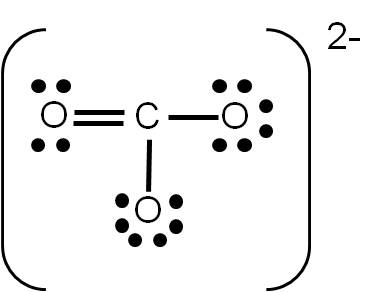
Ejemplo 3.8. Analicemos ahora la geometría del ión carbonato CO32-. |
Tratándose de un ión molecular, podemos establecer también su geometría. Hemos determinado previamente su estructura de Lewis:
El carbono (átomo central) tiene número de coordinación 3, debido a que está unido a tres átomos de oxígeno y no tiene pares libres. Por tanto, estos tres átomos deben repelerse lo máximo posible entre ellos. Para que esto ocurra, debemos orientar los oxígenos hacia los vértices de un triángulo, ya que así estarán separados 120° entre ellos:
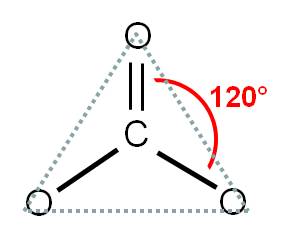
Por tanto, diremos que la geometría del ión carbonato es TRIANGULAR. Observa que la hibridación del carbono es sp2.
 |
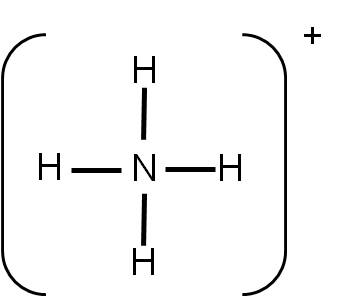
Ejemplo 3.9. Analicemos ahora la geometría del ión amonio NH4+. |
La estructura de Lewis es la siguiente:
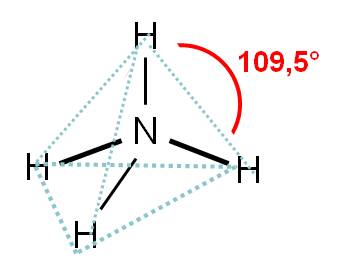
El número de coordinación del nitrógeno es 4. Por tanto, los cuatro átomos unidos querrán separarse lo máximo posible. Orientarse hacia los vértices de un cuadrado los separaría 90°, pero mejor resulta orientarse hacia los vértices de un tetraedro, ya que en este caso, los átomos de hidrógeno estarán separados entre ellos 109,5°.
En consecuencia, la geometría del ión amonio es TETRAÉDRICA. Observa que la hibridación del átomo de nitrógeno es sp3.
Pero, ¿y qué pasa con aquellos átomos centrales que sí poseen pares libres? En tales casos, debemos considerar a los pares libres para saber la orientación que tendrán los orbitales. Sin embargo, cuando determinamos la geometría, LOS PARES LIBRES NO SE DEBEN CONSIDERAR, ya que la geometría sólo está determinada por los átomos que conforman una molécula.
 |
Ejemplo 3.10. Veamos los casos del agua (H2O) y del amoníaco (NH3). |
Ambas moléculas tienen número de coordinación 4.
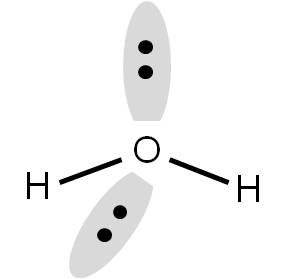
En el agua, tenemos dos átomos unidos y dos pares libres. Por tanto, los orbitales que contienen a los electrones correspondientes deben orientarse hacia los vértices de un tetraedro:
Sin embargo, al momento de determinar la geometría de la molécula, no debemos tomar en cuenta los pares libres. Por tanto, si los eliminamos, observaremos que el agua tiene una geometría ANGULAR (tipo búmeran), donde el ángulo entre H-O-H es 109,5°.
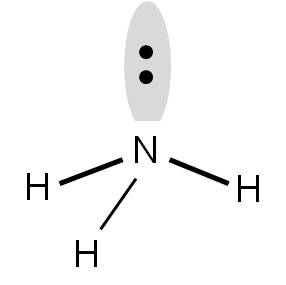
En el caso del NH3, el átomo central tiene tres átomos unidos y un par de electrones libre. (número de coordinación 4) Nuevamente, los orbitales deben orientarse hacia los vértices de un tetraedro:
Al momento de decidir la geometría, no debemos considerar el par libre. Por tanto, vemos que los tres átomos de hidrógeno están orientados hacia los vértices de un triángulo, pero con el nitrógeno destacando por encima: una especie de pirámide con base triangular. Esta geometría se llama PIRÁMIDE TRIGONAL.
El siguiente cuadro resume la geometría de las moléculas según el número de coordinación que presenten.
Figura 3.5. Geometría molecular según el número de coordinación.
El siguiente vídeo te mostrará la repulsión de pares de electrones usando globos. Podrás comprobar que los orbitales quieren estar lo más cómodos posibles, y por ello, se repelen lo máximo posible:
 |
Ejercicio 3.7 Para las siguientes especies SCl2, PCl3, CCl4 y NO3–, determinar:
|