[Visto: 1671 veces]
MÉTODOS INDUSTRIALES PARA PREVENIR LA FORMACIÓN DE ACRILAMIDA EN ALIMENTOS
La acrilamida es un compuesto orgánico de bajo peso molecular, muy hidrosoluble, que se forma al cocinar determinados alimentos ricos en almidón a temperaturas superiores a 120 ºC y con baja humedad (frituras, asados); esto es debido principalmente a la reacción de Maillard, que se produce entre ciertos aminoácidos, tales como la asparagina libre, y los azúcares reductores (glucosa, fructosa y otros) y que confiere a los alimentos un color dorado, influyendo además en su sabor.
La acrilamida está clasificada por la Agencia Internacional de Investigación del Cáncer (IARC) como probable carcinógeno en humanos (Grupo 2A) debido a que la acrilamida es biotransformada en el metabolito glicidamida con actividad genotóxica con especial afinidad por el sistema nervioso.
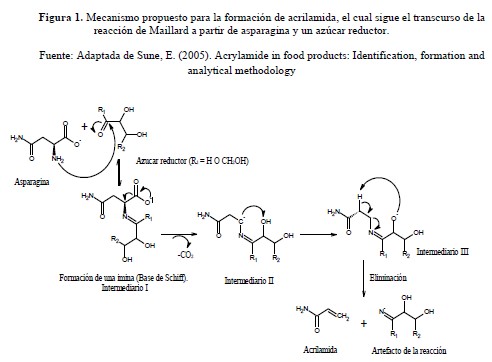
CARACTERÍSTICAS QUE FAVORECEN LA FORMACIÓN DE ACRILAMIDA
- DE ACUERDO AL PROCESO AL QUE SEAN SOMETIDOS
A. Proceso de fritura
Los factores de más importancia para la formación de acrilamida en alimentos son la temperatura y el contenido de humedad. Como se indica, su formación inicia a temperaturas superiores de 120°C, sin embargo sometiendo alimentos a temperaturas por encima de 180°C se observa una disminución de esta reacción debido a que se produce una degradación de estas. Indudablemente, la disminución de la temperatura produce una menor cantidad de acrilamida, pero se producen efectos negativos en la calidad del alimento, como es la absorción de grasa y una textura deficiente. Además la cantidad de alimento a freír determina el descenso de temperatura que se produce al sumergirse el alimento en el aceite y el tiempo de fritura necesario para recuperar la temperatura inicial y por ende la formación de acrilamida, debido a que el producto está con una temperatura inicial más baja que la del aceite y por lo tanto toma tiempo en llegar a un equilibrio.
B. Proceso de horneado
Durante el proceso de horneado, ocurre simultáneamente una transferencia de calor y de masa que produce cambios físicos y químicos en el alimento, como lo son cambios de volumen, evaporación de agua y formación de la corteza. Tal como ocurre en el proceso de fritura, la temperatura y la humedad son parámetros críticos, se concluyó que la acrilamida se forma en la corteza de los productos horneados.
C. Proceso de tostado
El tostado del café implica la transferencia de calor a través de la estructura del grano, el transporte de vapor de agua, CO2 y compuestos volátiles, como también cambios de volumen, estructura y composición. La formación de acrilamida tiene lugar en el comienzo del tueste.
2. De acuerdo al tipo de alimento
A. Café
En el café se ha detectado la presencia de acrilamida, formada durante el proceso de tostado y sus niveles pueden variar dependiendo de las diferentes variedades de café utilizadas. Esto dificulta la identificación de un método para optimizar el tostado, y así disminuir la formación de acrilamida. No hay estudios que permitan bajar los niveles de acrilamida formados y se sugiere el tostado por convección, aunque no está claro si es posible utilizarlo. No se dispone aún de tecnologías adecuadas para disminuir los niveles de azúcares reductores en el café. Sin embargo se vienen desarrollando estrategias para disminuir su formación debido a su importancia, considerando que el elevado consumo de café puede contribuir a aumentar los niveles de exposición poblacional.
B. Papas fritas
Los factores más importantes que determinan la formación de acrilamida son la composición de las papas, el tipo de suelo, variedad, las condiciones de almacenamiento pos cosecha y las variables del proceso de preparación como lo son la temperatura del aceite y el tiempo de fritura.
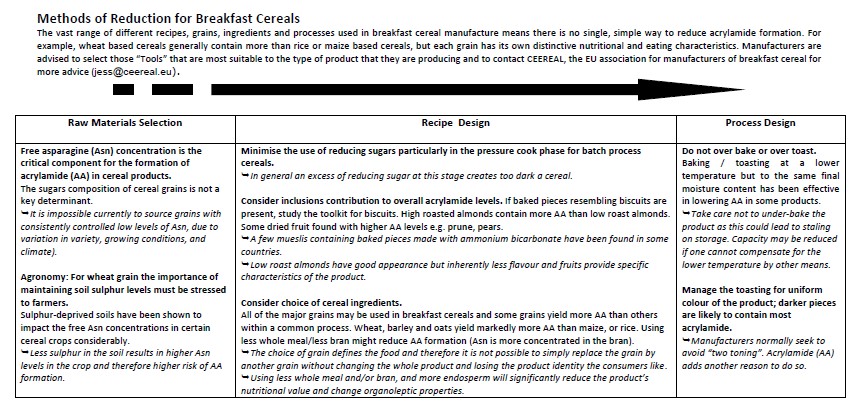
C. Cereales
En el caso de los cereales y los productos elaborados con cereales, como el pan, las galletas y los cereales para el desayuno, el contenido de asparagina es la materia prima determinante más importante en la formación de acrilamida. Se dispone de poca información sobre el contenido de asparagina en los diversos cereales. Por lo común, la concentración de asparagina puede oscilar entre 75 a 2200 mg/kg en el trigo, 50 a 1400 mg/kg en la avena, 70 a 3000 mg/kg en el maíz, 319 a 880 mg/kg en el centeno, y de 15 a 25 mg/kg en el arroz. Este nivel de variación indica que puede haber un margen para reducir la acrilamida aprovechando la variabilidad de asparagina. Las harinas ligeras contienen bastante menos asparagina que las harinas integrales. Sin embargo, si se reduce el contenido de harina integral se reducen las ventajas nutritivas del producto final.
MÉTODOS FÍSICOS
Consiste en desarrollar procesos en los cuales se modifiquen la temperatura, el tiempo, la humedad durante la transformación. Como se sabe, hay una relación entre la temperatura y el tiempo para la formación de acrilamida en los alimentos. Es por esto que una alternativa en las papas fritas es disminuir la temperatura o el tiempo de fritura utilizando vacío, encontraron que, en los alimentos ricos en grasa, el contenido inicial de agua es un factor determinante para desencadenar la formación de acrilamida, esto es debido a que el perfil de tiempo-temperatura durante el calentamiento se puede cambiar notablemente cuando una cantidad diferente de agua está presente. Estos resultados indican diferentes efectos de la actividad de agua en la formación de productos de Maillard y acrilamida. Si se controla la humedad, puede ser posible para desarticular estas reacciones concurrentes. Por lo tanto, la reducción del contenido inicial de agua puede ayudar a reducir la formación de acrilamida en grasa, mientras que el mantenimiento de un cierto nivel de humedad sería bueno para la reducción de acrilamida en los alimentos secos.
TEMPERATURA Y TIEMPO DE ALMACENAMIENTO
La temperatura y tiempo de almacenamiento de las papas influyen en el contenido en azúcares reductores. La acumulación de azúcares viene favorecida por las temperaturas bajas y el envejecimiento del producto. En las papas hay un equilibrio entre el contenido en almidón, y los azúcares reductores. El almacenamiento a temperaturas inferiores a 10 °C desplaza el equilibrio hacia la liberación de azúcares reductores que intervienen en la reacción de Maillard. Al aumentar el contenido en azúcares reductores en el proceso de fritura se formará mayor cantidad de acrilamida. El contenido en glucosa es cuatro veces mayor y el de fructosa es cinco veces mayor en papas almacenadas a 3 °C que en papas almacenadas a 10 °C. Otros autores también han señalado un mayor contenido en azúcares reductores en las papas almacenadas a 4 °C en comparación con la almacenada a 8 °C. Por ello, se recomienda almacenar las papas destinadas a freír a temperaturas por encima de 8 °C, de esta forma se reduce al mínimo el efecto del endulzamiento por bajas temperaturas, a temperaturas más bajas se acumulan azúcares reductores, especialmente cuando el almacenamiento es prolongado. Un periodo de almacenamiento a temperaturas superiores a 10 °C desplaza el equilibrio hacia la síntesis de almidón a expensas de los azúcares reductores. Por ello, las papas que han sido almacenadas en refrigeración se deben reacondicionar a temperaturas más elevadas durante 3 semanas a 15 °C. Por otro lado, el almacenamiento a altas temperaturas puede ocasionar problemas, ya que cuanto más elevada es la temperatura de almacenamiento antes se produce la germinación. Se debe evitar la germinación ya que determina cambios en la calidad de los tubérculos, además se asocia con un incremento de los azúcares reductores.
A nivel industrial, en Estados Unidos la FDA (2016), recomienda a los fabricantes consultar con los servicios locales de extensión agraria para identificar variedades de papas con bajo contenido de azúcares reductores disponibles en su región y en las diferentes épocas del año, o pedir a sus proveedores que ofrezcan variedades con bajo contenido de azúcar reductor cuando sea posible. Debido a esta problemática en Estados Unidos se están desarrollando nuevas variedades de papas con menor contenido en azúcares reductores y mayor resistencia al endulzamiento inducido por el frío, al igual que se están desarrollando cultivos (tanto por mejora genética convencional como por ingeniería genética) con menores niveles de asparagina, precursor de acrilamida.
RECOMENDACIONES Y PERSPECTIVAS
Como regla general, incluso para la comida preparada en casa, debería asumirse una posición radical: dorado sí, tostado no. Esto implica cocinar el tiempo justo y necesario, sin excesos (ni de tiempos ni de temperatura).
En la actualidad existen diversas estrategias para reducir los niveles de acrilamida en el café, las papas fritas y los cereales. Uno de los alimentos con niveles altos de acrilamida son las papas fritas debido a su alto contenido de azucares reductores y asparagina libre adicional a las altas temperaturas propias del proceso de fritura.
El lavado previo a la fritura de las papas reduce el contenido de azucares reductores lo cual favorece la disminución en la producción de acrilamida.
En investigaciones recientes demostraron experimentalmente que el contenido final de acrilamida en producto de papa congelado para freír disminuye significativamente, hasta en un 89 % en un proceso de fritura a 180 °C, si previamente se realiza la descongelación del producto en microondas, dicha reducción se relaciona con un tiempo menor de fritura necesario para obtener características organolépticas similares al producto sin descongelar.
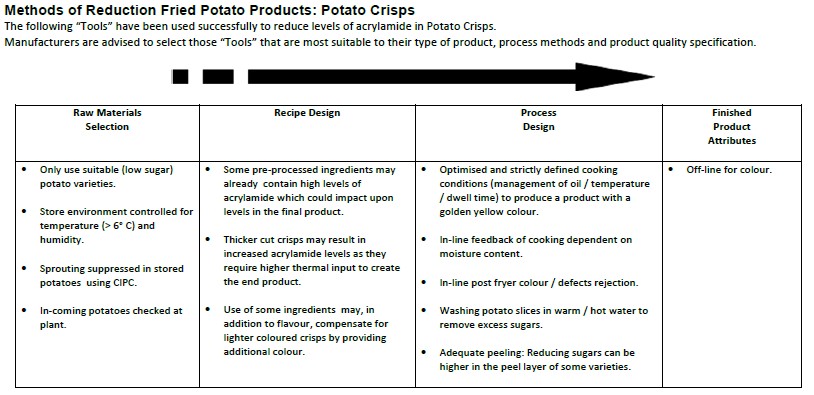
Existe una herramienta de prevención y reducción de acrilamida en los alimentos, destinada a las industrias implicadas, ha sido elaborada por la Food and Drink Europe en colaboración con la Comisión Europea y se va actualizando de forma periódica. La última actualización en 2013, incluye cuatro categorías diferentes de alimentos: patatas fritas, pan (cereales de desayuno, galletas y productos de panadería), café (tostado y molido, instantáneo y sucedáneos de café) y alimentos infantiles (galletas y cereales infantiles y alimentos para lactantes). La herramienta detalla los métodos existentes para reducir la acrilamida en los alimentos y permite a los usuarios evaluar y seleccionar los métodos de reducción que deben utilizar en función de sus necesidades de fabricación.
BIBLIOGRAFÍA:
- Sanny, M., Luning, P.A., Marcelis, W.J., Jinap, S. y Van Boekel, M. (2010). Impact of control behavior on unacceptable variation in acrylamide in French fries. Trends Food Sci Technol, 21,256–267
- Romani, S., Bacchiocca, M., Rocculi, P. y Rosa, M.D. (2008). Effect of frying time on acrylamide content and quality aspects of French fries. Food ResTechnol, 226, 555–560.
- Claus, A., Weisz, G. M., Kammerer, D. R., Carle, R., Schieber, A. (2005). A method for the determination of acrylamide in bakery products using ion trap LC-ESI-MS/MS. Mol Nutr. Food Res, 49, 918 – 945
- Food Drink Europe. (2011). Food Drink Europe Acrylamide Toolbox 2011. Disponible en: http://ec.europa.eu/food/food/chemicalsafety/contaminants/ciaa_acrylamide_toolbox09.pdf.
- Biedermann-Brem, S., Noti, A., Grob, K., Imhof, D., Bazzocco, D., y Pfefferle A. (2003). How much reducing sugar may potatoes contain to avoid excessive acrylamide formation during roasting and baking. Eur Food Res Technol 217, 369–373.
- Food and Agriculture Organization y Organización Mundial de la Salud [FAO y OMS] (June 2002). Consultation on the Health Implications of Acrylamide in Food. 25-27, Geneva, Switzerland. Recuperado de: http://www.who.int/foodsafety/publications/chem/en/acrylamide_full.pdf?ua=1
- Gül, A.H. y Vural, G. (2014). Mitigation of acrylamide and hydroxymethyl furfural in instant coffee by yeast fermentation. Food Research International, 6, 252–256.
- Surkyk, N., Rosen, J., Andersson, R., y Aman, P. (2004). Effects of asparragine, fructose, and baking conditions on acrylamide content in yeast-leavened wheat bread. J Agric Food Chem 52, 2047–2051.
- Low, M.Y., Koutsidis, G., Parker, J., Elmore S., Dodson, A. y Mottram, D. (2006). Effect of citric acid and glycine addition on acrylamide and flavor in a potato model system. Journal of Agricultural and Food Chemistry, 54, 5976–5983.
- Mogol, B. y Gökmen, V. (2014). Mitigation of acrylamide and hydroxymethylfurfural in biscuits using a combined partial conventional baking and vacuum post-baking process: Preliminary study at the lab scale. Innovative Food Science and Emerging Technologie.