IONIZACIÓN DEL AGUA, ÁCIDOS DÉBILES Y BASES DÉBILES
Aunque gran parte de las propiedades del agua como disolvente se pueden explicar en función de la molécula neutra de H2O, debe tenerse también en cuenta el pequeño grado de ionización del agua en iones hidrógeno (H+) e iones hidroxilo (OH–). Al igual que todas las reacciones reversibles, se puede describir la ionización del agua mediante una constante de equilibrio. Cuando se disuelven ácidos débiles en agua, su ionización aporta H+, las bases débiles consumen H+ al protonarse. Estos procesos también están gobernados por constantes de equilibrio. La concentración total de ión hidrógeno se puede medir experimentalmente y se expresa como el pH de la solución. Para predecir el estado de ionización de los solutos en agua, hemos de tener en cuenta las constantes de equilibrio pertinentes para cada reacción de ionización. Haremos por tanto ahora una breve discusión sobre la ionización del agua y de los ácidos y bases débiles disueltas en la misma.
El agua pura está ligeramente ionizada
Las moléculas de agua tienen una ligera tendencia a ionizarse reversiblemente para proporcionar un ión hidrógeno (protón) y un ión hidroxilo, dando el equilibrio.
H2O = H+ + OH –
Aunque normalmente se muestra el producto de disociación del agua como H–, los protones libres no existen en disolución; los iones hidrógeno formados en el agua son inmediatamente hidratados a iones hidronio (H3O+). La formación de enlaces de hidrógeno entre las moléculas de agua hace que la hidratación de los protones disociados sea virtualmente instantánea:

La ionización del agua puede medirse a través de su conductividad eléctrica; el agua pura conduce la corriente eléctrica al migrar H3O+ hacia el cátodo y OH– hacia el ánodo. El movimiento de los iones hidronio e hidroxilo en un campo eléctrico es extremadamente rápido en comparación con el de otros iones tales como el Na+, K+ y Cl–. Esta elevada movilidad iónica es el resultado del “salto de protones” que se muestra en la Figura 1.
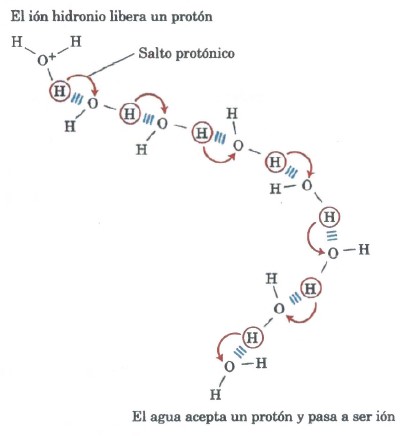
Ningún protón individual se mueve muy lejos a través de la disolución, pero una serie de saltos de protones entre moléculas de agua unidas por enlaces de hidrógeno causa el movimiento neto de un protón a una gran distancia en un tiempo notablemente corto. Como resultado de la elevada movilidad iónica del (y del OH–, que también se mueve rápidamente mediante salto de protones, pero en la dirección opuesta), las reacciones ácido-base en disolución acuosa son excepcionalmente rápidas. Tal como se ve, el salto de protones también desempeña probablemente un papel en las reacciones biológicas de transferencia de protones (Fig. 2).

Puesto que la ionización reversible es crucial para el papel del agua en la función celular, hemos de tener una manera de expresar el grado de ionización del agua en términos cuantitativos. Un breve repaso de algunas propiedades de las reacciones químicas reversibles nos mostrará cómo podemos hacerlo. La posición del equilibrio de cualquier reacción química viene dada por su constante de equilibrio, Keq (a veces expresada simplemente como K).
BIBLIOGRAFÍA:
- Lehninger, 2009, Principios de Bioquímica, Quinta edición, España, Ediciones omega.
- Harper, 2009, Bioquímica ilustrada, 28 edición, México, Mcgraw-hill interamericana editores.

¿La acidez y la alcalinidad de una solución tiene que ver con la forma de cómo están orientadas las moléculas de agua que rodean las partícula?
Buenos días Angeline según el estudio de Aceves-Navarro Everardo “Análisis de la teoría aceptada sobre la disociación del agua” La acidez y la alcalinidad de una solución no tiene nada que ver con la actividad del ion hidrógeno en la solución, sino con la orientación de las moléculas de agua que rodean las partículas, moléculas o iones en solución; los cuales participan en la formación de una nueva estructura y generan cambios y modificaciones en la separación interna entre el hidrógeno y oxígeno de las moléculas de agua, en términos de electro negatividad, polaridad, concentración y la intensidad de la carga de estos solutos. Esto explica el hecho de que el OH- contenido en el componente HOCL, ácido hipocloroso, actúa como ácido, mientras que en otro componente como NaOH, OH-actúa como base.