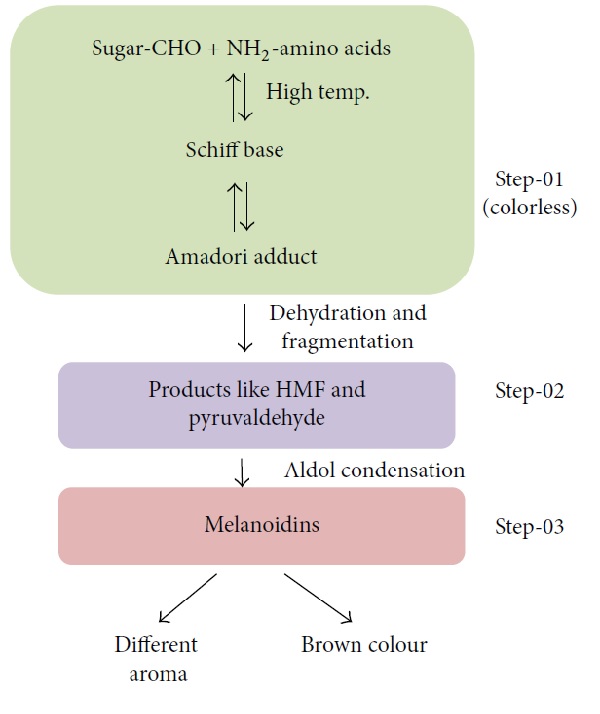
Las tortas, la crema batida e incluso la cerveza son alimentos consumidos con bastante regularidad por toda la población y es que son productos de buen sabor y textura que los hace atractivos. Pero, ¿que sería si encontrásemos bizcochos duros, crema batida aguada y una cerveza sin su característica espuma? Tal vez dejarían de ser consumidos a pesar de su buen sabor. Es por eso la importancia de las propiedades funcionales de las proteínas que mejoran el aspecto y textura de los alimentos. Dentro de ellas tenemos a la propiedad espumante, la cual consiste en la formación de una fase acuosa continua y una fase gaseosa dispersa.
Las propiedades de textura únicas y la sensación en la boca que los productos con esta propiedad dejan, se deben a las diminutas burbujas de aire dispersas en todo el alimento. En mucho de estos productos, las proteínas son su componente mayoritario y por lo tanto son los agentes activos de superficie principales que ayudan a la formación y estabilización de la fase gas dispersa.
Las espumas siguen 3 pasos principales para formarse. Primero, la proteína globular soluble se difunde por la interfase gas/agua, concentrándose y reduciendo la tensión superficial. Segundo, las proteínas se desdoblan en la interfase orientando su lado polar hacia las moléculas de agua; lo cual resulta en una orientación de la molécula proteica hacia el lado hidrofílico e hidrofóbico. Por último, los polipéptidos interactúan para formar una película delgada con una posible desnaturalización parcial y coagulación. Las proteínas rápidamente son adsorbidas en la interfase y forman una película estable alrededor de las burbujas, las cuales promueven la formación de una espuma.
En general, el burbujeo, batido o agitado de una solución proteica crea espumas estabilizadas por proteínas. La propiedad espumante de una proteína se refiere a su habilidad de formar una película delgada y resistente en una interfase líquido-gas, de manera que grandes cantidades de burbujas de gas puedan ser incorporadas y estabilizadas. Las propiedades espumantes son evaluadas de diferentes maneras. La capacidad espumante de una proteína se refiere a la cantidad de área interfacial que puede ser creada por la proteína y puede ser expresado como el volumen de espuma estable (overrun) o el poder espumante (FP). La proteína debe migrar a la interfase, adsorberse y reorganizarse. Las proteínas de bajo peso molecular, solubles y flexibles, forman espuman con alta capacidad de retención de aire, sin embargo, dichas espumas pueden ser inestables. La proteína debe formar un film rígido y viscoelástico estable que rodee a la burbuja de gas. Las proteínas que interactúan con moléculas vecinas, que polimericen, o que tengan alto peso molecular y puedan formar múltiples capas, aumentarán la estabilidad de la espuma.
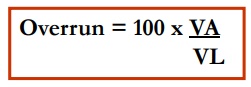
Donde: VA = Volumen de la espuma
VL = Volumen del líquido inicial

En espumas, las burbujas de aire dispersas, en la fase continua de capas líquidas delgadas, pueden variar de tamaño oscilando entre 1 μm hasta varios centímetros de diámetro. Dichas variaciones afectarán directamente a la tensión superficial y viscosidad de la fase líquida. Una distribución homogénea de burbujas pequeñas le brinda al alimento suavidad y ligereza, así como un incremento de la dispersión y perceptibilidad de los aromas.
Factores que afectan la estabilidad de la espuma
En general muchas propiedades espumantes se ven afectados principalmente por la concentración de proteína que contenga el alimento. A mayor concentración de proteína más rígida será la espuma, esto se debe a la formación de pequeñas burbujas y a la alta viscosidad de la fase acuosa. Entonces, la estabilidad de la espuma se verá incrementada por el aumento de concentración de la proteína, ya que esto aumenta directamente la viscosidad y facilita, por lo tanto, la formación de películas proteicas, cohesivas y en multicapas en la interfase.
La capacidad espumante alcanza su máximo valor en algún punto durante el incremento de la concentración de la proteína. Algunas proteínas, por ejemplo, la albúmina, son capaces de formar espumas relativamente estables a una concentración del 1%, mientras la proteína aislada del suero de leche se hará estable a una concentración en un rango de 2-5%. En general, la mayoría de proteínas alcanzan su valor máximo de capacidad espumante en un 2-8% de concentración proteica, donde la concentración interfacial de proteínas en la espuma se encuentra en un rango de 2-3 mg/m2.
Existen, además, otros factores que se deben tener en cuenta para mantener la espuma en un alimento, estos son: el pH, la presencia de sales, la presencia de azúcares y la presencia de lípidos.
En el caso del pH, las espumas muestran estabilidad cerca a un pH isoeléctrico, ya que la carencia de interacciones de repulsión favorecen las interacciones proteína-proteína y por lo tanto la formación de una película viscosa en la interfase. Además, una gran cantidad de proteína es absorbida en la interfase a ese punto, debido a la falta de fuerzas de repulsión en la interfase y las moléculas absorbentes. Estos dos factores son determinantes para mejorar la capacidad espumante y la estabilidad.
El efecto de la adición de sales en las propiedades espumantes dependen del tipo de sal y las características de solubilidad de la proteína en la solución salina. La capacidad espumante y la estabilidad de la mayoría de proteínas globulares, como albúmina de huevo, gluten, entre otras, incrementan con el incremento de la concentración de NaCl. Esto se atribuye a la neutralización de las cargas de los iones salinos. Sin embargo, algunas proteínas como la del suero de leche exhiben un comportamiento opuesto.
Efecto de la adición de azúcares. La adición de sacarosa (en su mayoría) a soluciones proteicas, usualmente causa que la espuma sea más estable, debido a un incremento en la viscosidad de la fase, la cual reduce la velocidad de drenado del fluido de las micelas. Por otro lado, la capacidad espumante disminuye, esto es porque la proteína es menos capaz de desdoblarse y se adsorbida en la inferfase. Es por eso que se recomienda añadir el azúcar luego del batido, por ejemplo al preparar merengue.
Efecto de la adición de lípidos. Debido a que los lípidos (especialmente fosfolípidos) son más activos en la superficie que las proteínas, los lípidos se adsorben mejor en la interfase gas-agua e inhibe la adsorción de las proteínas durante la formación de la espuma. Las películas formadas por lípidos carecen de propiedades cohesivas y viscoelásticas para poder soportar la presión interna de las burbujas en una espuma, estas burbujas se expanden y colapsan rápidamente durante el batido. Es por eso que un suero al cual se han extraído la grasa, forma mejor y más estable espuma que un suero sin desgrasar.
Bilbiografía:
- Fennema R. Owen. (2000). Química de los alimentos. Segunda edición. España, Editorial Acribia.
- J. F. Zayas. (1997). Functionality of Proteins in Food. Springer-Verlag Berlin Heidelberg
- Foegeding, E. & Luck, P.J. & Davis, J.P.. (2006). Factors determining the physical properties of protein foams. Food Hydrocolloids. 20. 284-292. 10.1016/j.foodhyd.2005.03.014.