Autoras: Gudiel, Hellyn & Florez, Cynthia
¿Qué razones tenemos para pensar que la utilización de solventes alternativos cumple con todos los requisitos para ser un solvente verde?, decir que cumplen con la factibilidad al reciclado, baja toxicidad, eficiencia en la separación del producto, y bajo consumo energético para su síntesis es lo que iremos descubriendo en esta presentación.
Iniciaremos diciendo que los solventes tradicionales como el hexano, tolueno, acetona, éter etílico, entre otros, son productos con propiedades terribles para el medio ambiente y la salud por propiedades inherentes a ellos como su inflamabilidad, toxicidad y falta de biodegradabilidad. Por tanto, las reacciones donde no intervienen los solventes de naturaleza orgánica son una alternativa verde que ayuda a disminuir las emisiones a la atmósfera y proporciona un ambiente más saludable para la industria, a la vez que mejora su eficiencia y disminuye sus costos. Sin embargo, es necesario precisar que hoy en día se tienen alternativas para la reutilización de solventes orgánicos y existen equipos de recuperación de solventes basados en principios de filtración por membrana, adsorción con carbón activado e incluso por destilación. Algunos de estos métodos son usados por diferentes industrias como la industria de pintura, pudiendo recuperar hasta un 90% de solvente, reduciendo así la eliminación de este y el gasto en nuevo solvente1.
Aun así, se está optando por nuevos tipos de solventes que son más viables, entre los principales tenemos a los compuestos fluorados, los fluidos supercríticos y los líquidos iónicos, los cuales vamos a describir para conocer si son realmente una alternativa verde1.
Los solventes fluorados son solventes químicamente inertes, no tóxicos, térmicamente estables, no polares y de alta densidad, que tienen enlaces C-F en vez de C-H. Algunos ejemplos de estos son las aminas con cadenas fluoradas y alcoholes con cadenas fluoradas que se utilizan en la síntesis de resinas. Sin embargo, presentan un alto costo y permanecen en el ambiente, además que poseen una escasa capacidad disolvente que hace necesario modificar los compuestos que se desee disolver en ellos1.
Los fluidos supercríticos son fluidos que se encuentran por encima de su presión y temperatura critica, es decir, se encuentra en dos fases: liquida y gas. Posee propiedades de fluir como gas y a la vez es capaz de disolver compuestos como un líquido. Se pueden ajustar sus propiedades con variaciones de presión y temperatura, poseen altas solubilidades y bajas viscosidades, los cuales mejoran los procesos de transferencia de materia. Un excelente ejemplo es el CO2 líquido que se utiliza en la producción de café descafeinado. Pese a lo anterior expresado, presenta inconvenientes como un alto costo en el equipamiento, y la baja solubilidad de compuestos orgánicos en estos fluidos1.
Los líquidos iónicos son sales incoloras que se encuentran compuestas por iones en estado líquido y cuya presión de vapor es nula. Existen varios ejemplos, como aquellos que contienen tanto cationes y aniones orgánicos como N-alquilpiridiun, tetralquilfosfonio, y aquellos que presentan un catión orgánico y un anión inorgánico. Estos son utilizados para reacciones como la hidrogenación, hidroformilación, oxidación y dimerización, donde su uso es selectivo2.
Asimismo, tienen propiedades de estabilidad térmica y pueden diluir a diversos compuestos orgánicos. Parecen ser perfectos, pero se ha advertido que tienen una toxicidad intrínseca, poca biodegradabilidad, y provienen de compuestos derivados del petróleo, además de que sus síntesis suelen generar residuos2.
Por otra parte, ha surgido una tendencia que se enfoca en no utilizar solventes de ningún tipo. Pero, ¿qué significa que una reacción sea libre de solventes? Bueno, se considera que una reacción sin solvente es aquella que tiene una fase sólida seca, y también lo es aquella en la que está presente un líquido pero que este no actúa como un solvente. Las ventajas que esto acarrea es que hay ocasiones en las que las reacciones han tenido beneficios inesperados como reacciones más rápidas, mejores rendimientos o una mejor selectividad y otros evidentes, como la eliminación de solventes, disminución de la contaminación, reducción del gasto y una simplificación del proceso químico3.
Otros casos de reacciones libres de solvente incluyen aquellas en las que se tiene una mezcla de sustancias que tiene un punto de fusión menor al de la temperatura ambiente, si una o varias de las sustancias son los reactantes, entonces se daría una reacción sin solvente, con la posibilidad de que el producto tenga un punto de fusión superior a la temperatura ambiente y resulte un sólido fácilmente purificable3. También se encuentran consideradas las reacciones que se dan por pulverización, en la que ambos reactantes se colocan en un mortero y se pulveriza la mezcla, dando lugar a la reacción. Esto último ha sido reportado en condensaciones aldólicas y de Claisen, así como reacciones inorgánicas.
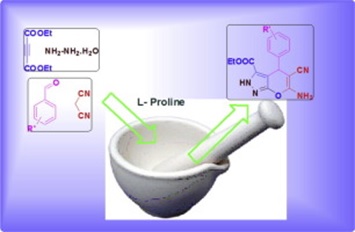
Figura 1. Síntesis de derivados de dihidropirano[2,3-c]pyrazol via una reacción de 4 componentes por el método de molienda.
Algunos autores han llamado síntesis libres de solventes a reacciones en las que el reactivo líquido está presente en exceso, actuando como reactivo y solvente al mismo tiempo. De igual forma, han llamado síntesis libre de solventes a reacciones que no necesitan solventes en la fase de síntesis pero que sí los necesitan en la fase de extracción y purificación. No sería correcto entonces, hablar de síntesis libre de solventes en estos casos3.
La desventaja radica entonces en que se malinterpreta la definición de una reacción libre de solventes, haciendo dificultosa la recaudación de información en concordancia a su definición. En un aspecto más práctico, una desventaja serían las reacciones exotérmicas4, ya que en las reacciones libres de solventes, cuando hay formación de agua, esta se evapora rápidamente por el calor producido por la reacción, y si se aumenta el volumen de agua generada (escalamiento del proceso), podría causar un descontrol en la seguridad del procedimiento. Y aunque no se formara agua, el uso de reactantes explosivos o inflamables en reacciones exotérmicas también se volvería más difícil de controlar.
En conclusión, es un hecho que hay que ir disminuyendo paulatinamente el uso de solventes orgánicos, para lo cual se han postulado diversas opciones. Sin embargo, no hay un método universal. Es necesario hacer estudios previos de la reacción, sus condiciones y las sustancias que se van a utilizar, para poder comparar eficientemente los distintos tipos de reacciones, sus beneficios y desventajas, y escoger cuál se va a utilizar.
Bibliografía
- Alonso D, Baeza A, Chinchilla R, Gómez Lucas C, Guillena G, Marset X, et al. Mezclas eutécticas como alternativa sostenible a los disolventes convencionales en Química Orgánica. An la Real Soc Española Química. 2018;114(2):79–87.
- Díaz Alvarez JCMRRBAR. Líquidos iónicos : propiedades fisicoquímicas y aplicación potencial en el mejoramiento de crudos pesados Ionic liquids : physicochemical properties and potential application in upgrading of heavy crude oils. Rev ION. 2012;25(1):61–87.
- Dicks, A. Green Organic Chemistry in Lecture and Laboratory. Vol. 17, Organic Process Research & Development. 2013. 603–603 p.
- Kolb VM. Green Organic Chemistry and Its Interdisciplinary Applications. Green Organic Chemistry and Its Interdisciplinary Applications. 2017.
